智启医学新维度
服务电话: 180-1784-7121(微信同号)
Molecular Cell文献解析 | 颠覆传统认知!蛋白酶体可通过切割宿主蛋白生成AMPs直接对抗**感染
研究背景
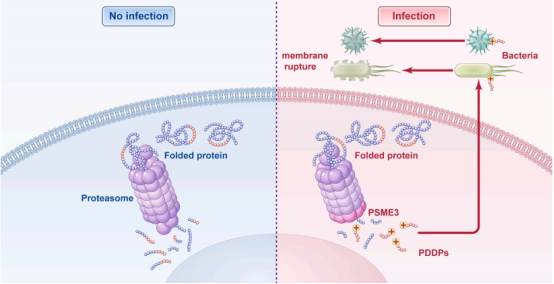
蛋白酶体是细胞内负责降解泛素化蛋白质的关键复合体,传统认知集中于其维持蛋白质稳态的功能。然而,Goldberg等人的研究揭示了蛋白酶体在抗**天然免疫中的全新角色:通过切割宿主蛋白生成**肽(Antimicrobial Peptides, AMPs),直接参与宿主防御。这一发现突破了蛋白酶体功能的传统边界,为理解天然免疫机制提供了新视角,并为开发新型***(尤其是针对多重耐药菌)提供了潜在策略。
研究内容
1. 蛋白酶体生成AMPs的假设验证:
生物信息学预测:通过模拟蛋白酶体切割位点,发现15%-27%的体液肽段与计算机预测的切割产物一致,其中1.2%的肽段具有AMP特征(如带正电荷、可破坏**膜)。
功能实验验证:
蛋白酶体抑制剂:抑制蛋白酶体活性会增强**感染,提示其参与**防御。
条件培养基分析:**感染后,细胞培养基中<10 kDa的肽段具有**作用,且该作用可被蛋白酶K消除,证实活性成分为肽段。
2. 蛋白酶体来源防御肽(PDDPs)的鉴定与应用:
质谱分析(MAPP):结合评分系统筛选出高评分肽段,合成后验证其对多种**(包括耐药性铜绿假单胞菌)的抑制效果。
体内**潜力:PDDPs(如PPP1CB来源肽)在小鼠模型中显著缓解急性肺炎和菌血症,并可通过诱导降解标签系统增强**效果。
3. **感染触发PDDP生成的机制:
切割模式转变:感染后蛋白酶体从糜蛋白酶样活性转为胰蛋白酶样活性,倾向于生成带正电荷的AMPs。
PSME3的关键作用:感染后PSME3与蛋白酶体结合增强,调控β2亚基活性(负责胰蛋白酶样切割),且其**功能部分独立于NF-κB通路。
研究方法
1. 多组学整合分析:
计算机模拟切割:预测人类蛋白质组的蛋白酶体切割位点,评估生成肽段的AMP潜力。
质谱技术(MAPP):高通量鉴定感染后蛋白酶体切割产生的肽段,筛选候选PDDPs。
2. 功能实验验证:
体外**测试:使用合成PDDPs评估对革兰氏阳性/阴性菌的抑制效果及膜渗透能力。
体内模型:通过小鼠急性肺炎和菌血症模型验证PDDPs的**效果。
基因调控实验:敲低PSME3或使用降解标签系统,研究其对PDDP生成及**功能的影响。
3. 机制解析:
蛋白酶体活性分析:比较感染前后切割活性的变化,结合免疫共沉淀-质谱技术(IP-MS)鉴定PSME3的招募。
研究结果
1. PDDPs的广谱**性:合成的PDDPs对包括多重耐药菌在内的多种病原体有效,且可通过膜渗透机制杀死胞内外**。
2. 感染诱导的蛋白酶体重编程:**感染通过招募PSME3改变蛋白酶体切割偏好,优先生成带正电荷的AMPs。
3. **潜力验证:PDDPs在体内模型中显著降低**负荷,提示其作为新型***的可行性。
**性与价值
1. 科学**:
功能拓展:**揭示蛋白酶体在天然免疫中的直接**作用,突破了其“蛋白质垃圾桶”的传统角色。
机制突破:发现PSME3通过调控蛋白酶体切割模式生成AMPs,为天然免疫信号转导提供新机制。
2. 临床意义:
新型***开发:PDDPs具有广谱**活性,尤其对耐药菌有效,为应对***耐药危机提供新策略。
**优化方向:通过化学修饰(如引入非天然氨基酸)提高PDDPs的稳定性,可增强其临床应用潜力。
3. 未来研究方向:
多细胞器协同:探索溶酶体等其他细胞器是否参与AMP生成,构建完整的宿主防御网络。
信号机制解析:阐明**感染如何触发PSME3招募至蛋白酶体的分子通路。
PDDPs工程化:优化肽段稳定性(如延长半衰期)并评估其体内**性和药效动力学。
总结
本研究通过多学科交叉方法,系统揭示了蛋白酶体在抗**免疫中的新功能,不仅深化了对天然免疫机制的理解,还为开发基于宿主防御肽的新型***提供了理论依据。其**性在于将蛋白酶体的蛋白质降解功能与免疫防御直接关联,为抗感染**开辟了全新路径。未来研究需进一步解析调控机制并推动PDDPs的临床转化,以应对全球***耐药性挑战。
